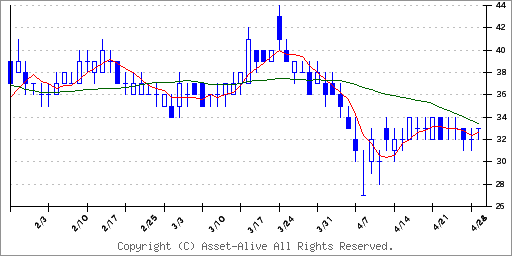
注目銘柄
 2018/8/28 16:40
2018/8/28 16:40
(4597) ソレイジア・ファーマ 公募増資などで約43億円を調達。SP-04の開発投資などに充当
ソレイジアファーマは、公募増資などで約43億円を調達する。SP-04の主に第3相臨床試験を中心とする承認申請に至るまでに必要な開発への投資や権利導入元へのマイルストン費用支払いに充当する。
SP-04は、これまで権利導入元のスウェーデンのPles社により、欧米での第2相臨床試験、米国での第1相臨床試験などが完了している。
2018年下期に、ソレイジア・ファーマの権利地域のうち、日本、韓国、台湾、香港において、がん化学療法に伴う末梢神経障害を適応症として第3相臨床試験を開始する。第3相臨床試験は、Pled社が実施する欧米地域に、ソレイジア・ファーマの権利地域である日本、韓国、台湾、香港を参画する国際共同臨床試験の形態を持って、Pled主導で実施される。臨床試験では、SP-04の初回投与から9か月後における、中等度以上の慢性末梢神経障害を有する被験者の割合を評価するとしている。
【がん化学療法に伴う末梢神経障害】
がん化学療法は、悪心や嘔吐、口内炎発症などの副作用が生じる。末梢神経障害も重篤な副作用の1つとなっている。
大腸がんの治療法における代表的な抗がん剤の組み合わせに、プラチナ製剤のオキサリプラチンを含むFOLFOX療法がある。
オキサリプラチンの処方は、患者の85%~95%で末梢神経障害が生じ、手足や唇周囲部などの異常感覚、四肢末梢のしびれ感、感覚低下などの症状を引き起こすという。
副作用が生じた場合は、薬剤中止により80%の症例で一部症状の改善がみられる。40%の症例で6~8カ月後には完全に回復するものと考えられている。しかしながら、薬剤中止はがん化学療法の中止や方針変更を意味し、末梢神経障害を治療することは重要な課題となっている。
これまでのところ、がん化学療法副作用として末梢神経障害を適応として承認された医薬品は存在していない。
SP-04は、これまで権利導入元のスウェーデンのPles社により、欧米での第2相臨床試験、米国での第1相臨床試験などが完了している。
2018年下期に、ソレイジア・ファーマの権利地域のうち、日本、韓国、台湾、香港において、がん化学療法に伴う末梢神経障害を適応症として第3相臨床試験を開始する。第3相臨床試験は、Pled社が実施する欧米地域に、ソレイジア・ファーマの権利地域である日本、韓国、台湾、香港を参画する国際共同臨床試験の形態を持って、Pled主導で実施される。臨床試験では、SP-04の初回投与から9か月後における、中等度以上の慢性末梢神経障害を有する被験者の割合を評価するとしている。
【がん化学療法に伴う末梢神経障害】
がん化学療法は、悪心や嘔吐、口内炎発症などの副作用が生じる。末梢神経障害も重篤な副作用の1つとなっている。
大腸がんの治療法における代表的な抗がん剤の組み合わせに、プラチナ製剤のオキサリプラチンを含むFOLFOX療法がある。
オキサリプラチンの処方は、患者の85%~95%で末梢神経障害が生じ、手足や唇周囲部などの異常感覚、四肢末梢のしびれ感、感覚低下などの症状を引き起こすという。
副作用が生じた場合は、薬剤中止により80%の症例で一部症状の改善がみられる。40%の症例で6~8カ月後には完全に回復するものと考えられている。しかしながら、薬剤中止はがん化学療法の中止や方針変更を意味し、末梢神経障害を治療することは重要な課題となっている。
これまでのところ、がん化学療法副作用として末梢神経障害を適応として承認された医薬品は存在していない。